南京農業大學趙明文教授團隊在微生物權威期刊mBio雜志上發表靈芝纖維素利用機制的新發現
纖維素是植物細胞壁的主要成分,也是全球最豐富的可再生碳水化合物。由于其獨特的物理和化學結構,被認為是“鎖起來的能量庫”,“難啃的硬骨頭”。食用菌生產可將農作物秸稈、畜禽糞便和園林廢棄枝條等轉化為優質蛋白與健康食品,直接“變草為寶、點糞成金”。靈芝作為基因組中水解酶數量最多的食用菌之一,通過產生大量的纖維素酶來降解纖維素。最新研究證實,靈芝纖維素酶可把玉米秸稈、玉米芯等農業廢棄纖維素轉化為食用菌蛋白質。這相當于把“柴火”變成“瘦肉”,但靈芝如何利用纖維素的作用機制仍不清晰。
近日,南京農業大學趙明文教授團隊在微生物權威期刊mBio雜志上發表題為“GlSlt2 positively regulates GlMyb-mediated cellulose utilization in Ganoderma lucidum”的文章。該研究揭示了靈芝絲裂原活化蛋白激酶GlSlt2通過磷酸化修飾轉錄因子GlMyb促進靈芝纖維素利用的作用機制。

具體結果:
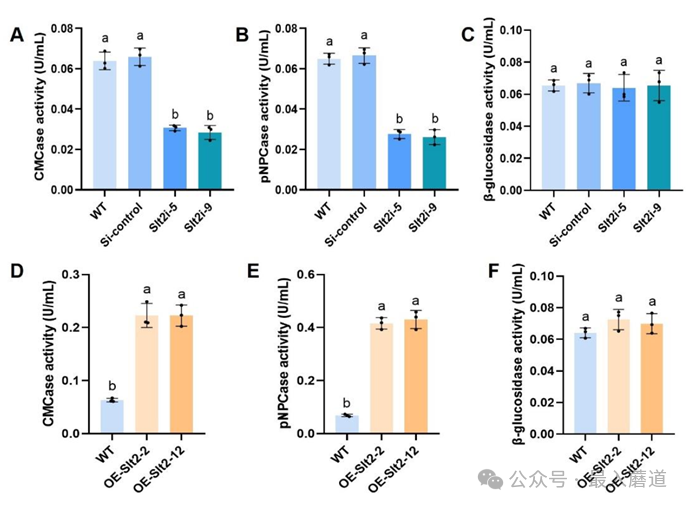
一、GlSlt2提高靈芝纖維素酶活性。為了研究絲裂原活化蛋白激酶GlSlt2在靈芝纖維素利用中的作用,我們檢測了GlSlt2沉默菌株和GlSlt2過表達菌株中的纖維素酶活性。結果顯示Slt2沉默菌株顯著低于野生型的內切纖維素酶活性(約降低55%)和外切葡聚糖酶活性(約降低58%)(圖1A和B)。Slt2過表達菌株中的內切纖維素酶和外切葡聚糖酶活性分別提高了2.5倍和5倍(圖1D和E),但沉默和過表達菌株中β-葡萄糖苷酶活性沒有顯著差異(圖1C和1F)。說明GlSlt2提高靈芝內切和外切纖維素酶活性。
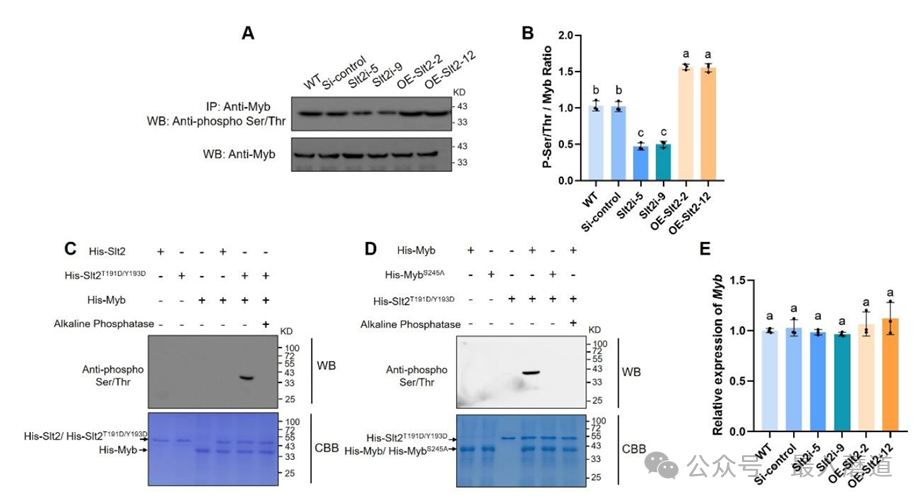
二、GlSlt2磷酸化修飾轉錄因子GlMyb。為了探究GlSlt2調控纖維素利用的分子機制,通過酵母雙雜交(Y2H)文庫篩選發現GlSlt2與R2R3型GlMyb轉錄因子結合。并通過Y2H實驗、雙分子熒光互補(BiFC)實驗和免疫沉淀實驗進行驗證(圖2)。GlSlt2作為蛋白激酶,能夠磷酸化修飾相互作用的蛋白。通過體內、體外磷酸化實驗驗證了GlSlt2對GlMyb的磷酸化,并找到了245位絲氨酸是磷酸化修飾的位點(圖3)。

三、磷酸化的GlMyb提高纖維素酶基因表達并激活纖維素酶活性。為了研究GlMyb調控纖維素酶活性的分子機制,通過酵母單雜交實驗、EMSA和染色質免疫沉淀實驗(ChIP-qPCR)驗證了GlMyb可以與纖維素酶相關基因的啟動子結合情況。發現第245位絲氨酸的磷酸化增強GlMyb與纖維素酶基因(CBH1、CBH3、EG1、EG3和EG5)啟動子的結合能力(圖4)。進一步采用了RNAi技術篩選了GlSlt2-GlMyb的雙沉默菌株(Slt2i-Mybi-2和Slt2i-Mybi-3),并測定了內切纖維素酶和外切葡聚糖酶的活性。酶學測定表明,與GlSlt2單沉默菌株相比,GlSlt2-GlMyb雙沉默菌株的內切纖維素酶和外切葡聚糖酶活性顯著降低,其水平與GlMyb單沉默菌株中觀察到的酶活相似(圖5)。說明磷酸化的GlMyb提高纖維素酶基因表達并激活纖維素酶活性。


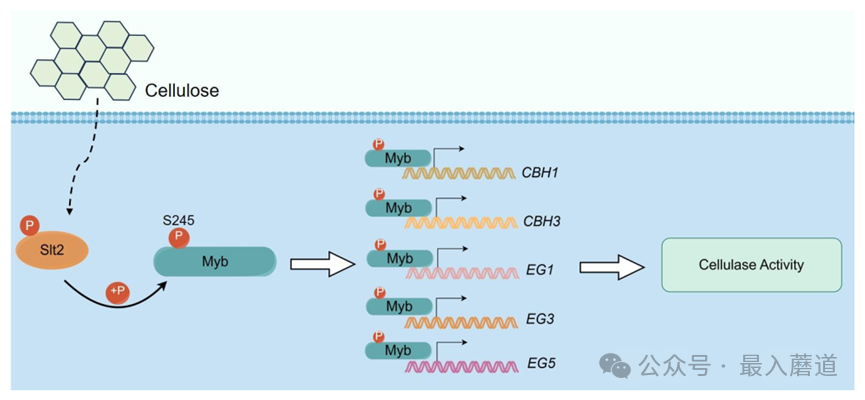
結論:在本項研究中探究了絲裂原活化蛋白激酶GlSlt2調控靈芝利用纖維素的作用機制,通過酵母雙雜交篩庫、雙分子熒光互補實驗和免疫沉淀實驗發現,GlSlt2能夠與R2R3型Myb轉錄因子相互作用,并且GlSlt2磷酸化修飾GlMyb的第245位絲氨酸。進一步通過酵母單雜交實驗、EMSA和ChIP-qPCR證明GlMyb的245位絲氨酸磷酸化促進其與多個纖維素酶相關基因啟動子的結合(纖維二糖水解酶CBH1和CBH3、內切葡聚糖酶EG1、EG3和EG5),并促進纖維素酶基因表達。本研究揭示了靈芝纖維素利用的作用機制,這些結果為生物質轉化和生物圈碳循環奠定了基礎。
來源:最入蘑道



